Kurze Einführung in die Forschungsarbeit der AG Springer für Interessierte
Schwerpunkt unserer Forschung ist das Immunsystem. Eine zentrale Rolle in seinem Kampf gegen Virusinfektionen und Krebs spielen die MHC Klasse I-Proteine (engl. major histocompatibility complex class I molecules). Wir untersuchen ihr molekulares Funktionieren und ihren Transport innerhalb der Zelle. Dabei gewinnen wir Erkenntnisse, die auch für andere Proteine und Prozesse grundlegend wichtig sind. Außerdem erarbeiten wir neue Methoden für diagnostische und biotechnologische Verwendungszwecke.
MHC Klasse I-Proteine sind auf der Oberfläche beinahe jeder Zelle unseres Körpers. Sie haben die Aufgabe, Veränderungen von Zellen aufzudecken, die durch das Vorhandensein von intrazellulären Parasiten (z.B. Viren) oder von entarteten Zellstrukturen bei Krebserkrankungen hervorgerufen werden. Solche Veränderungen entstehen während des Krankheitsverlaufs innerhalb der betroffenen Zelle als kleine Proteinfragmente (Peptide), die an die Klasse I-Moleküle binden. Der Klasse I-Peptid-Komplex wird anschließend aus dem Zellinnern an die Zelloberfläche transportiert, wo er den zytotoxischen T-Lymphozyten (CTL) präsentiert wird. Sobald ein CTL einen solchen Komplex und damit das Peptid als pathologische Veränderung erkennt, zerstört er die betroffene Zelle. So wird eine entstehende Krebszelle vernichtet, bevor sie sich vermehren und im Körper ausbreiten kann. Gleiches gilt für virusinfizierte Zellen: Stirbt die Zelle, verlieren die Viren ihren Wirt und damit die Grundlage zur Herstellung neuer Viren; die Ausbreitung der Infektion auf gesunde Körperzellen wird gestoppt.
Der intrazelluläre Transport von Klasse I-Proteinen aus dem Zellinnern bis zur Zelloberfläche ist ein interessanter und hochregulierter Prozess, denn er ist abhängig von der Anwesenheit des Peptids: Nur im Komplex mit einem gebundenen Peptid kann das Klasse I-Protein die Oberfläche erreichen. Leere Klasse I-Proteine ohne Peptidpartner werden im Innern der Zelle zurückgehalten. Der biologische Sinn liegt womöglich darin, dass leere MHC Klasse I-Moleküle auf einer gesunden Zelle keine Peptide binden sollen, die statt aus dem eigenen Innern aus kranken Nachbarzellen stammen; denn dieses Szenario könnte zum Tod einer gesunden Zelle führen.
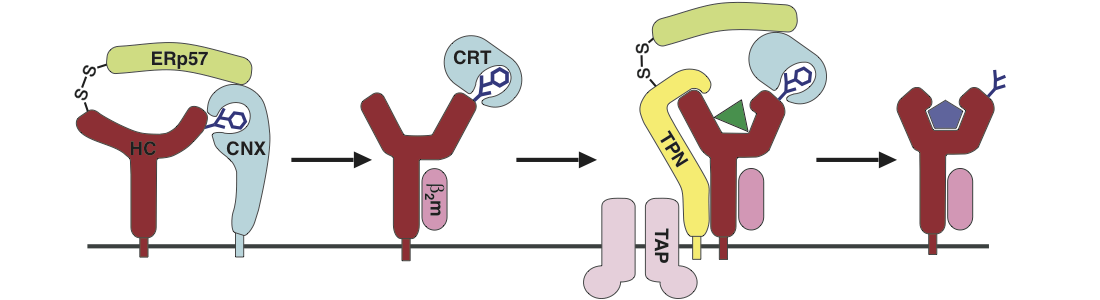
Die Beladung eines Klasse I-Proteins mit einem Peptid ist ebenfalls hochgradig reguliert. Sie erfolgt mit Hilfe des sog. Peptid-Beladungs-Komplexes (PLC). Es handelt sich hierbei um eine Gruppe verschiedener Proteine, die im Endoplasmatischen Retikulum (ER) – einem Zellkompartiment, in dem neben anderen Substanzen auch Klasse I-Proteine entstehen – die Reifung des Klasse I-Proteine unterstützen und es mit einem passenden Peptid versehen. Der PLC ermöglicht auf diese Weise, dass intakte Klasse I-Peptid-Komplexe hergestellt werden, die die Zelloberfläche erreichen, so dass Virusinfektionen oder tumoröse Zellveränderungen vom Immunsystem erkannt und vernichtet werden können.
Unsere Forschungsarbeit beschäftigt sich mit den Ursachen und Mechanismen des intrazellulären Klasse I-Transports. Wir verwenden hierzu eine Kombination aus zellbiologischen (z.B. Immunfluoreszenz-Mikroskopie), biochemischen (z.B. Proteintransport-Experimente) und biophysikalischen (z.B. Schmelzpunktanalysen) sowie theoretischen Methoden (z.B. Computer-gestützte Modellsimulation). Einige Fragestellungen unserer Arbeitsgruppe sind:
- Ist die intrazelluläre Retention von leeren Klasse I-Molekülen statisch oder dynamisch? Mit anderen Worten: Werden leere Klasse I-Moleküle, die kein Peptid enthalten, in einem bestimmten Zellkompartiment festgehalten? Oder sind sie in der Lage, zwischen verschiedenen Zellkompartimenten hin und her zu pendeln? Unsere Untersuchungen haben gezeigt, dass leere wie Peptid gebundene Klasse I-Moleküle den Ort ihrer Entstehung, das ER, verlassen können. Während jedoch die beladenen Formen zur Zelloberfläche transportiert werden, zirkulieren die leeren Klasse I-Moleküle zwischen verschiedenen intrazellulären Kompartimenten hin und her und bleiben auf diese Weise durch einem dynamischen Prozess im Zellinnern gefangen.
- Wie werden Klasse I-Moleküle als „leer“ erkannt? Mit anderen Worten: Wie unterscheiden sich leere und Peptid gebundene Klasse I-Moleküle voneinander? Wir konnten in Simulationsstudien feststellen, dass die molekulare Struktur von Klasse I in Abwesenheit von Peptid deutlich labiler ist, und somit das Peptid zur Stabilisierung des Moleküls beiträgt. Möglicherweise wird die erhöhte Labilität eines leeren Klasse I-Moleküls von zellulären Komponenten (z.B. dem PLC) erkannt und der intrazelluläre Retentionszyklus eingeleitet.
- Wie werden leere Klasse I-Moleküle in dem intrazellulären Retentionszyklus festgehalten? Mit anderen Worten: Wer erkennt leere Klasse I-Moleküle und sorgt für ihre intrazelluläre Retention? Wir konnten beobachten, dass Calreticulin, ein Mitglied des PLC, eine wichtige Rolle bei der dynamischen Retention von Klasse I-Molekülen spielt. Da die Anwesenheit von Calreticulin die Bindung von Peptid begünstigt, könnte der intrazelluläre Kreislauf eine funktionelle Rolle bei der Reifung von Klasse I-Molekülen spielen und auch andere PLC-Mitglieder involvieren.
- Können die anderen Mitglieder des PLC zusammen mit Klasse I das ER verlassen und auch in anderen Zellkompartimenten ihre Funktion erfüllen? Unsere bisherigen Daten bestätigen, dass mindestens zwei weitere PLC-Mitglieder, TAP und Tapasin, außerhalb des ER zu finden sind. Da der PLC eine entscheidende Rolle für die Peptidbindung spielt, liegt die Überlegung nahe, dass die Reifung von Klasse I-Molekülen nicht auf das ER beschränkt ist, sondern auch in anderen Zellkompartimenten stattfinden kann oder sogar muss.
Wir bearbeiten außerdem die Endozytose von MHC-Klasse I-Proteinen.
Wir haben kleine Moleküle entdeckt, die die Antigenpräsentation manipulieren, indem sie Peptide von Klasse I-Proteinen austauschen.
Wir entwickeln außerdem neue Nachweisreaktionen mit Hilfe von Polyelektrolyt-Nanokapseln.
Einblicke in unsere Forschungsarbeit finden Sie auch in der englischen Beschreibung und, natürlich, in unseren Publikationen. Oder schreiben Sie uns!
Presseartikel über unsere Arbeit:
- Forscher der Jacobs University Bremen gründeten eine Firma für biomedizinische Reagenzien (2019)
- Neue Erkenntnisse über die Autoimmunkrankheit Morbus Bechterew (2018)
- Biomarker besser nachweisen: Bremer Forscher entwickeln neue Methode mit Mikrokapseln (2018)
- Vom ewigen Kampf der Viren und Zellen (Weserkurier Bremen, 2017)
- Der moderne Mensch erbte Immun-Gen vom Neandertaler (2013)
- Immunsystemreaktion kann nun einfacher nachvollzogen werden (2013)
- Mikro-Shuttles
- Transportmechanismen
- Ernst A.-C.-Lange-Preis